Минздрав лицензировал 3 лекарства, содержащие «Молнупиравир» отечественного производства
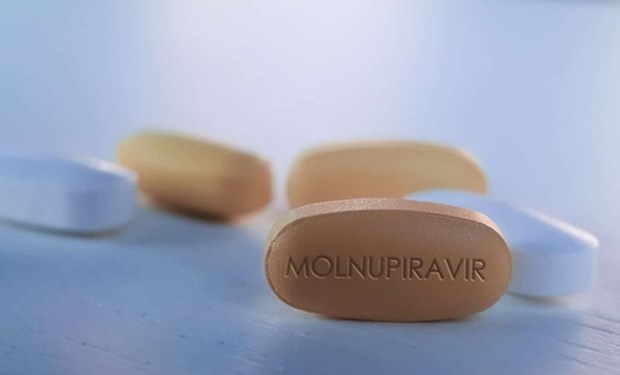 Иллюстративное изображение (Источник: ВИА)
Иллюстративное изображение (Источник: ВИА)17 февраля директор Управления по лекарственным средствам Вьетнама (Министерство здравоохранения) подписал решение об издании списка из 3 лекарства, содержащих «Молнупиравир» отечественного производства, которым выданы свидетельства о регистрации обращения во Вьетнаме.
Три лекарства, которые лицензированы:
«Молравир 400»: содержание молнупиравира 400 мг, форма твердых капсул, срок годности 6 месяцев, производственный фармацевтической акционерной компанией Boston Vietnam.
«Мовинавир»: содержание молнупиравира 200 мг, форма твердых капсул, срок годности 6 месяцев, производственный Акционерным Обществом «Фармацевтическая компания Мекофар».
«Молнупиравир Стелла 400»: содержание 400 мг молнупиравира, форма твердых капсул, срок годности 8 месяцев, производственный «Совместным предприятием Стеллафарм» - филиал 1.
Лицензия на эти препараты действует в течение 3 лет с момента подписания решения.
Управление по лекарственным средствам Вьетнама требует, чтобы производственные предприятия и учреждения регистрировали лекарства для производства в соответствии с досье и документами, зарегистрированными в Министерстве здравоохранения; координировать свои действия с лечебными учреждениями для строгого соблюдения действующих правил в отношении отпускаемых по рецепту лекарств, контролировать безопасность, эффективность и нежелательное воздействие лекарств на вьетнамцев, а также синтезировать лекарства и докладывать в соответствии с правилами.
Министерство здравоохранения также поручило управлениям здравоохранения провинций и городов центрального подчинения уведомить диспансерные и лечебные учреждения, медицинский персонал и учреждения лекарственного обеспечения на местах, чтобы сообщить пациентам о преимуществах, рисках при использовании лекарств, лечении другими препаратами, которые могут заменить «Молнупиравир» при лечении COVID-19.
Управление по лекарственным средствам Вьетнама требует от подразделений усилить мониторинг, надзор и выявление случаев побочных реакций на лекарства (если таковые имеются), направлять отчеты в Национальный центр информации о лекарствах (Ханой) и отслеживать побочные реакции на лекарства или в Региональный центр информации о лекарствах и мониторинг нежелательных лекарственных реакций (Хошимин) в соответствии с нормативными документами.
В процессе обращения лекарств на основании мониторинга и обновления информации о безопасности и эффективности 3-х вышеперечисленных лекарства возможно принятие решения об отзыве данного выданного удостоверения о регистрации обращения в соответствии с пунктом 1 настоящей статьи Закона о фармацевтике./.